CNN
–
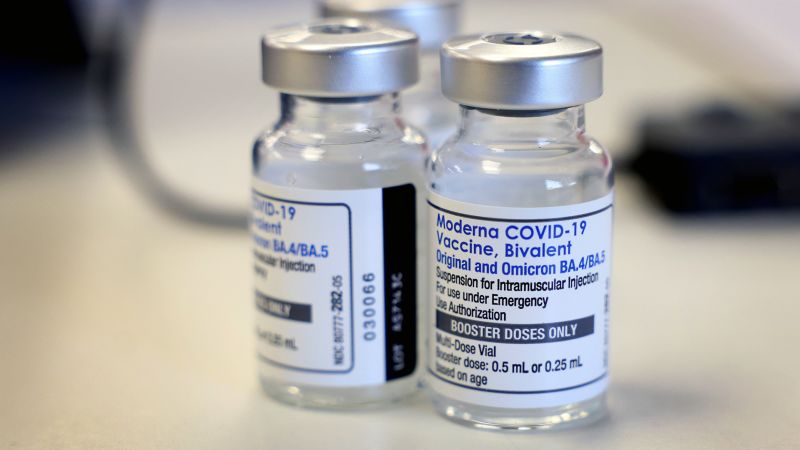
Administración estadounidense de alimentos y drogas enmendado Los términos de sus autorizaciones de uso de emergencia para vacunas bivalentes de Pfizer y Modern el martes, lo que permite a las personas de 65 años o más y ciertas personas con inmunidad debilitada obtienen dosis adicionales antes de las campañas de vacunación de este otoño.
Las vacunas bivalentes fabricadas por Pfizer y Moderna tienen instrucciones para combatir la cepa original del virus CovVI-19, así como Omicron y sus beneficios.
Han estado disponibles en los Estados Unidos desde septiembre bajo autorizaciones de uso de emergencia, o EUA, que restringen estrechamente cómo se pueden dar vacunas.
El martes, la FDA cambió los términos de las autorizaciones de estas vacunas para que algunas personas puedan obtener una dosis adicional frente a la mayoría de los demás.
A saber, los adultos de 65 años o más que han recibido una sola dosis de una vacuna bivalente pueden recibir una dosis adicional al menos cuatro meses después de su primera dosis.
La mayoría de las personas con ciertos grados de inmunocompromis que han recibido una primera dosis de una vacuna bivalente pueden obtener un segundo al menos 2 meses después. Se pueden administrar dosis adicionales a discreción de su proveedor de atención médica.
El Dr. Peter Hooz, quien codirige el Centro para el Desarrollo de Vacunas en el Hospital de Niños de Texas, pidió a la FDA que aumente el acceso a refuerzos bivalentes para aquellos que los desean. Él dice que en su mayor parte, el consejo de hoy de la agencia tiene significado.
“Mi única pregunta es por qué el límite de edad de 65? ¿En qué se basaba” en “normalmente hubiera preferido que se redujera a 60 o incluso 50”, dijo Hooz en un correo electrónico en CNN.
“Para los estadounidenses que entienden su importancia, deberíamos poner a disposición los segundos refuerzos bivalentes. Finalmente, pronto necesitaremos consejos sobre otro refuerzo anual de otoño. Realmente esa información vendrá este verano”, agregó.
Para los niños inmunocomprometidos de 6 meses a 4 años, la elegibilidad para dosis bivalentes adicionales dependerá de la vacuna recibida anteriormente, dijo la FDA en un comunicado de prensa.
Otro gran cambio es que la mayoría de las personas no vacunadas ahora pueden recibir una dosis única de una vacuna bivalente, en lugar de dosis musicales de vacunas de deformación originales, dijo la agencia. La FDA ha simplificado su recomendación para las personas no vacunadas después de reconocer que la mayoría de los estadounidenses ahora tienen cierta inmunidad contra Covid-19, incluso si es solo a través de infecciones pasadas.
“Ahora hay evidencia disponible de que la mayoría de la población estadounidense de 5 años o más tiene anticuerpos contra SARS-CoV-2, el virus que causa CoVID-19, o por vacunación o infección que puede usarse como base para la protección proporcionada por las vacunas bivalentales. Covid-19 continúa siendo un riesgo muy real para muchas personas, y nosotros alentamos a las personas a tener en cuenta la vacunación, especialmente con una etiqueta de vacunación con COVVVI-1. Resultados de Covid-19, que son una enfermedad grave, hospitalización y muerte “, dijo el Dr. Peter Marks, jefe del Centro de Evaluación e Investigación Biológica de la FDA, en un presione soltar.
Los niños de 6 meses a 5 años que aún no han sido vacunados ahora pueden recibir una serie de dos dosis de la vacuna bivalente moderna como una serie principal, o una serie de tres dosis de la vacuna bivalente de Pfizer-Biontech si tienen 6 meses de edad. Los niños de 5 años pueden recibir dos dosis de bivalente moderno o una sola dosis de la vacuna bivalente Pfizer-Biontech.
Los niños de 6 meses a 5 años que han comenzado su vacuna monovalente ahora pueden obtener una dosis de una vacuna bivalente, pero el número de dosis para las que calificarán dependerá de la cantidad de dosis que ya han tenido y el tipo de vacuna que han recibido.
La agencia enfatizó que la mayoría de las personas que han obtenido una dosis de una vacuna bivalente actualmente no son elegibles para una segunda dosis.
Y han alentado a todos aquellos que aún no han obtenido su primera dosis de vacuna bivalente para hacerlo, y muchos estadounidenses todavía están en este cubo.
Alrededor de solo el 17% de las personas elegibles, menos de 1 de cada 5 estadounidenses, obtuvieron una dosis recomendada.
Con el tiempo, los adultos con una función inmune reducida debido a su edad o problema de salud subyacente han preguntado a los médicos si necesitan otra dosis de vacunas bivalentes.
El Centro para el Control y la Prevención de Enfermedades de los Estados Unidos ha informado datos tempranos que muestran que la efectividad de las vacunas bivalentes, incluso contra las visitas y hospitalizaciones de las salas de emergencias, ya ha comenzado a disminuir.
Pero la agencia no era libre de hacer lo que se llama una recomendación “para permisos” en los refuerzos, lo que permitiría a los médicos ofrecer dosis adicionales a pacientes vulnerables debido a los términos de UEA.
Los términos actualizados otorgan a los CDC y su Comité Asesor sobre Prácticas de Vacunación (ACIP) más libertad para recomendar dosis adicionales de vacunas bivalentes. El APIP celebra una reunión sobre las vacunas CovVI-19 el miércoles y debería aprobar las modificaciones de la FDA.
Para todos aquellos que no están cubiertos por las modificaciones de hoy, la FDA dice que tiene la intención de tomar decisiones sobre futuras vacunas después de recibir recomendaciones sobre la composición de la cepa de otoño de su comité asesor en junio.
Ambos Canadá y el Reino Unido ofreció otra serie de refuerzos bivalentes a aquellos que más corren el riesgo de Covid-19 esta primavera.